2019-2020学年安徽省舒城桃溪中学新高考化学模拟试卷含解析.pdf
2.虚拟产品一经售出概不退款(资源遇到问题,请及时私信上传者)
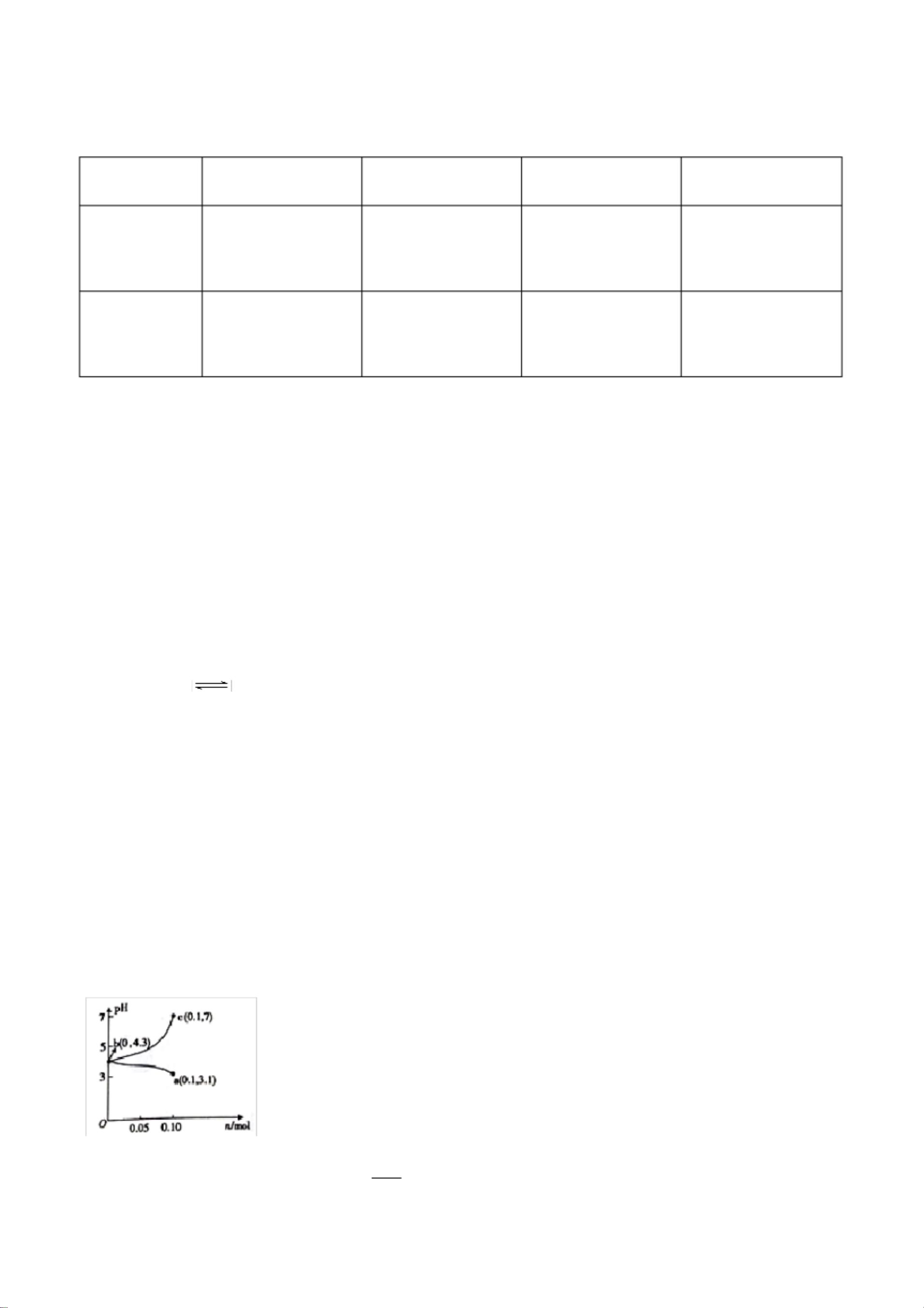
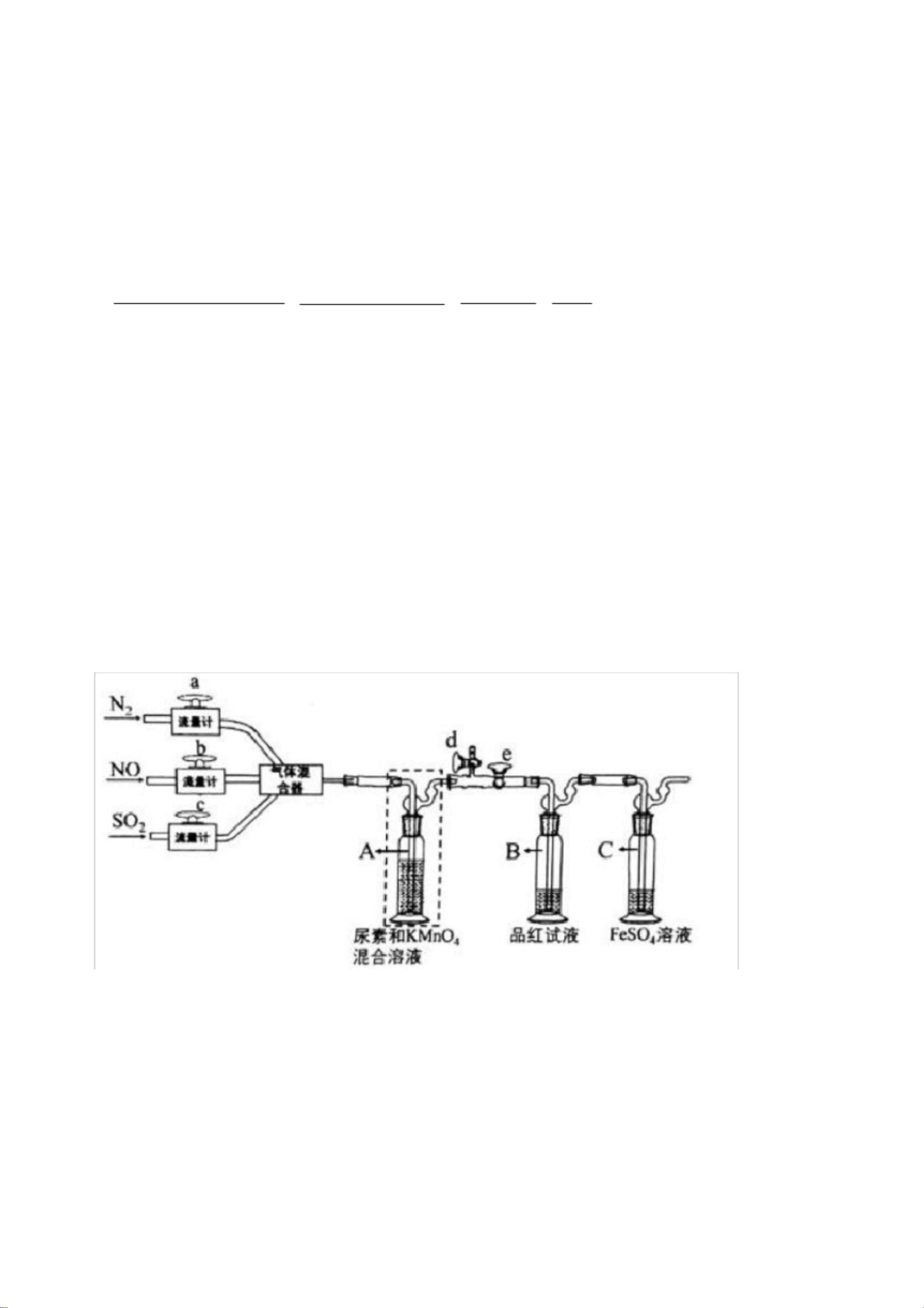
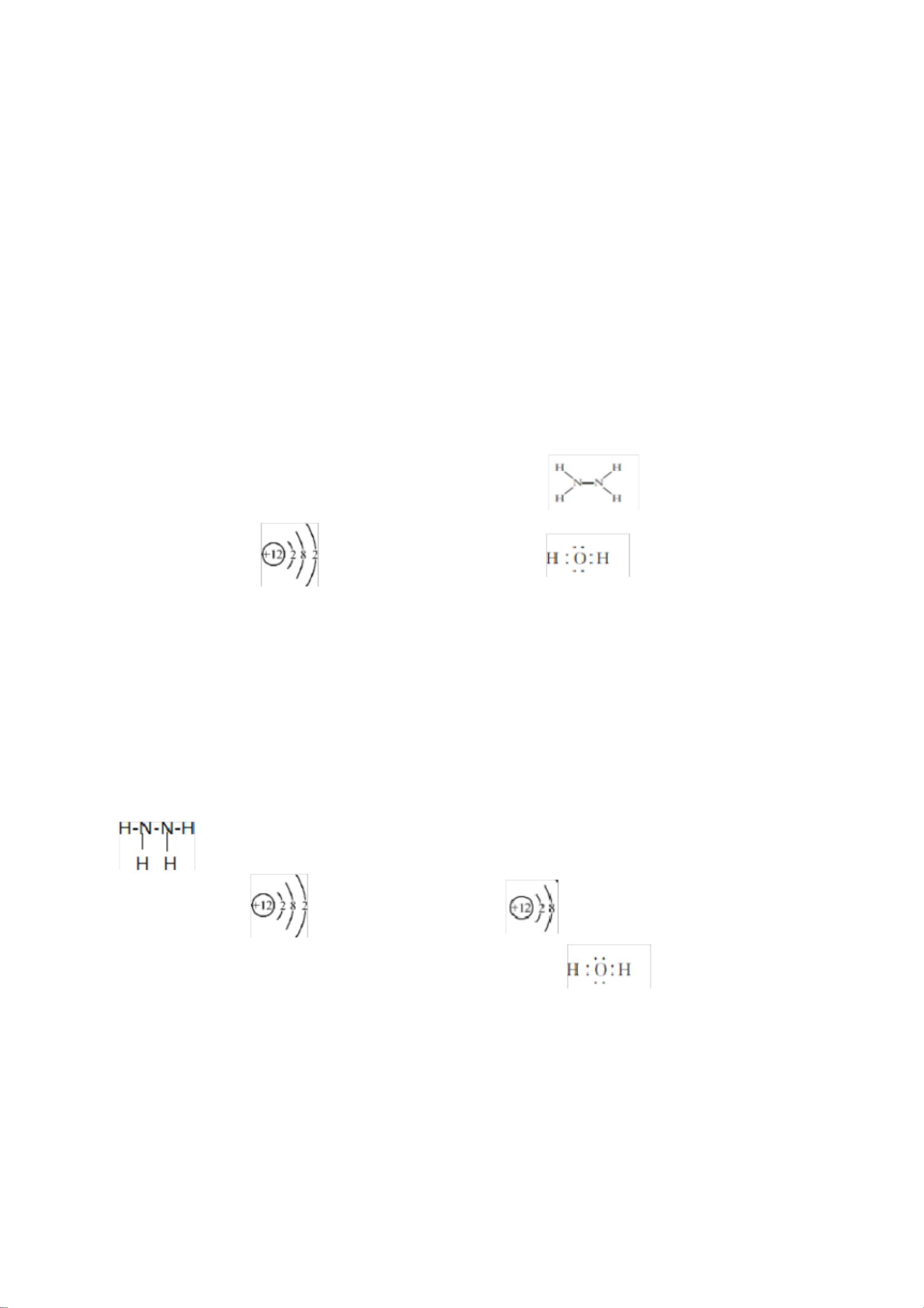
在深入探讨这份化学模拟试卷所涵盖的知识点之前,我们首先要了解化学作为一门科学,它不仅是纯理论的学习,更是一种对世界运作规律的探究。化学反应的多样性和复杂性要求我们对基本原理有深刻的理解,同时也需要在实验中培养严谨的观察与分析能力。安徽省舒城桃溪中学提供的这份新高考化学模拟试卷正是这一理念的体现。 氧化还原反应是化学中非常重要的一个章节,它涉及到元素之间的电子转移,是许多化学反应的基础。在本模拟试卷中,涉及的氧化还原反应通过颜色变化这一直观现象进行了描述。例如,FeSO4与NaOH反应过程中,铁元素从+2价氧化为+3价,进而形成红褐色Fe(OH)3沉淀,这一过程清晰地展示了氧化还原反应中元素价态变化所导致的物质颜色变化。此外,氯水与溶液的褪色反应、铜与稀硝酸反应生成的氮氧化物都是氧化还原反应的经典例子。这些知识点的掌握不仅对于考试至关重要,更对理解自然界中广泛存在的氧化还原过程具有实际意义。 弱酸的电离平衡常数Ka是另一个关键的知识点。试卷中所提到的醋酸电离平衡,直接关联到溶液的pH值。电离平衡是弱酸弱碱溶液中重要的概念,它不仅影响溶液的酸碱性,还影响到溶液中各种离子的浓度比例。通过pH值的测定,我们可以计算出Ka值,进而分析醋酸分子和醋酸根离子间的相互作用。电荷守恒原则则是解决此类平衡问题的一个重要方法,它基于化学反应前后电荷总量不变的原理,帮助我们理解不同离子在溶液中的浓度关系。 环保问题在当前社会日益凸显其重要性,因此,涉及烟气脱硫脱氮技术的题目不仅是对化学知识点的考察,更是对考生社会责任感的一种考验。试卷中提到了工业上常用的脱硫脱氮方法,这些方法在减少环境污染,改善空气质量方面发挥着重要作用。如KMnO4作为强氧化剂,在去除SO2方面表现出色,但对NO的吸收效果不佳,说明在实际应用中需要根据不同物质的性质选择合适的处理方法。这不仅是对考生化学知识的考查,也是对其解决实际问题能力的测试。 实验操作技巧在化学学习中同样占有重要地位。试卷中强调了实验操作前的准备、实验过程中的观察以及对实验现象的分析。如在实验操作前的排空操作,是为了确保实验环境的纯净,避免外来物质对实验结果的干扰。实验过程中的现象观察,如黑色固体的形成,能够为分析反应过程提供关键信息。这些技能对于学生来说是非常重要的基本功,它要求学生在实验中既要细心观察,又要能够通过现象分析出背后的化学原理。 总结而言,这份模拟试卷不仅仅是一次考试的练习,它更是一次全面考察学生对化学知识掌握情况和应用能力的机会。通过对氧化还原反应、弱酸电离平衡、环保相关化学反应及实验操作技巧的考察,试卷强调了化学知识与实际应用相结合的重要性。这些知识点的深入学习和理解,不仅可以帮助学生在高考中取得好成绩,更重要的是培养他们解决实际问题的能力,为将来的学习和工作打下坚实的基础。

剩余17页未读,继续阅读

- 粉丝: 0
- 资源: 2万+




 我的内容管理
展开
我的内容管理
展开
 我的资源
快来上传第一个资源
我的资源
快来上传第一个资源
 我的收益 登录查看自己的收益
我的收益 登录查看自己的收益 我的积分
登录查看自己的积分
我的积分
登录查看自己的积分
 我的C币
登录后查看C币余额
我的C币
登录后查看C币余额
 我的收藏
我的收藏  我的下载
我的下载  下载帮助
下载帮助

 前往需求广场,查看用户热搜
前往需求广场,查看用户热搜最新资源
- 数据结构上机实验大作业-线性表选题.zip
- 字幕网页文字检测20-YOLO(v5至v11)、COCO、CreateML、Paligemma、TFRecord、VOC数据集合集.rar
- 雪毅云划算试客系统v2.9.7标准版 含购物返利+免费试用+9.9包邮+品牌折扣+推广中心等
- 冒泡排序算法详解及Java与Python实现
- 实时 零代码、全功能、强安全 ORM 库 后端接口和文档零代码,前端(客户端) 定制返回 JSON 的数据和结构
- 混合有源滤波器(HAPF) MATLAB-Simulink仿真 仿真模拟的HAPF补偿前后,系统所含的谐波对比如下图所示
- csi-driver-nfs
- 认识小动物-教案反思.docx
- pdfjs2.5.207和4.9.155
- 2023-04-06-项目笔记 - 第三百五十五阶段 - 4.4.2.353全局变量的作用域-353 -2025.12.22
- OPCClient-UA源码OPC客户端源码(c#开发) 另外有opcserver,opcclient的da,ua版本的见其他链接 本项目为VS2019开发,可用VS其他版本的编辑器打开项目 已应
- 2023-04-06-项目笔记 - 第三百五十五阶段 - 4.4.2.353全局变量的作用域-353 -2025.12.22
- PHP快速排序算法实现与优化
- deploy.yaml
- 家庭用具检测15-YOLO(v8至v11)数据集合集.rar
- RuoYi-Cloud-Plus 微服务通用权限管理系统


 信息提交成功
信息提交成功