物质的结构与性质专项训练单元达标自检题检测试题.doc
2.虚拟产品一经售出概不退款(资源遇到问题,请及时私信上传者)
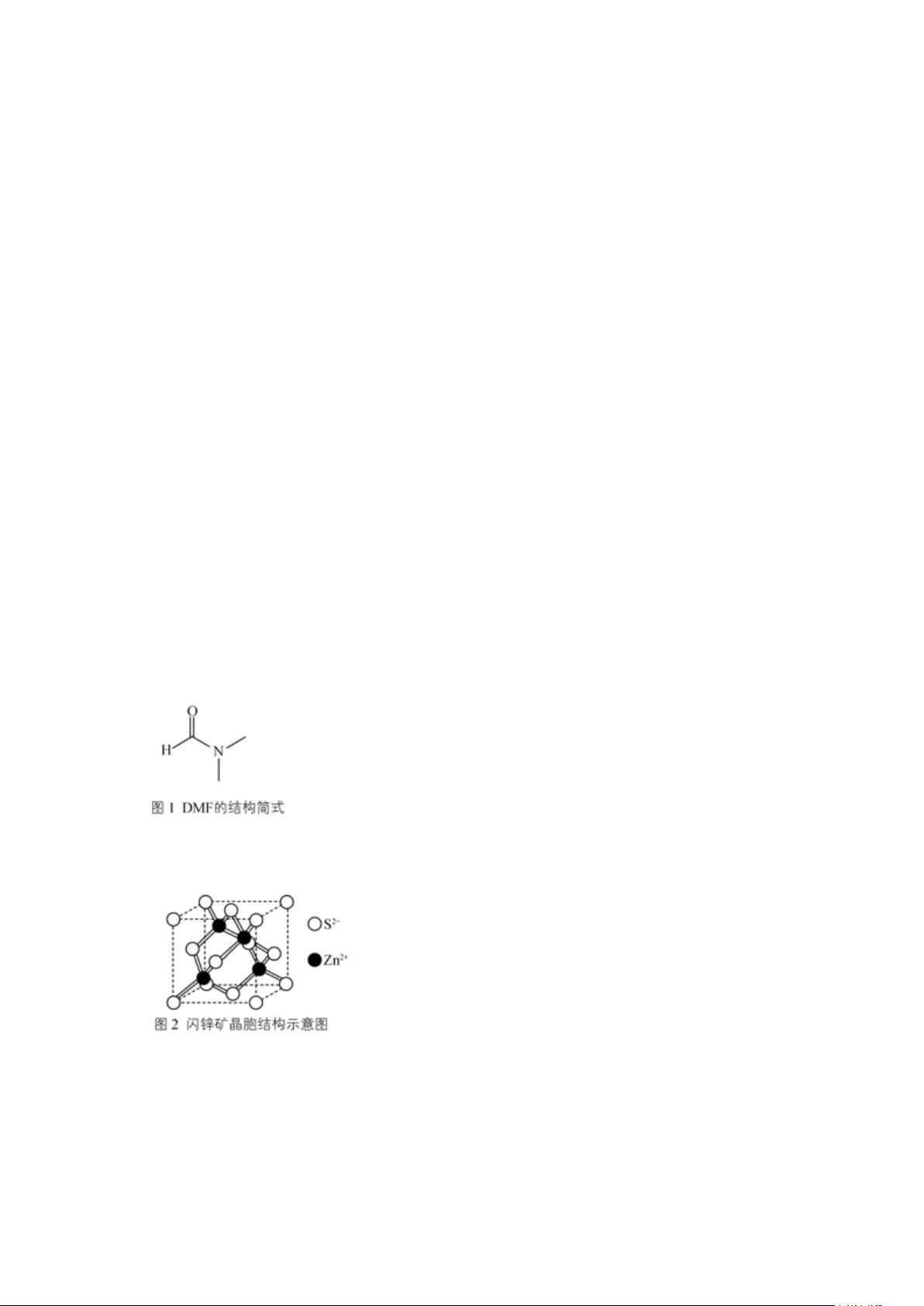
【物质的结构与性质】 1. 这个试题主要涉及化学元素周期表中元素的结构与性质。题目中提到的A、B、C、D、E、F六种元素,根据描述,A和E同族,最外层电子排布为ns1,这可能意味着它们属于第IA族,如氢或碱金属。B和D同族,最外层p能级电子数是s能级的两倍,可能是第IVA族,如碳或硅。C的最外层电子数是D的一半,可能为铝(Al),D可能是磷(P)。F有三个价电子,一个在d轨道,可能是铬(Cr)。具体答案如下: - A可能是氢(H)或锂(Li),B可能是碳(C),F是铬(Cr)。 2. 锌(Zn)的化合物与生物活动有关。Zn2+的电子排布是[Ar]3d104s2,失去这两个电子后,成为[Zn(NH3)4]2+。CO32-的空间构型是平面三角形,电负性顺序通常为O > N > C > H。DMF(N,N-二甲基甲酰胺)分子中碳原子的杂化轨道是sp3,1molDMF分子中有7个σ键。 3. 五氮阴离子盐(N5)6(H3O)3(NH4)4Cl的氮原子价层电子排布是2s22p3。元素的第一电子亲和能E1的变化与电子云的屏蔽效应和有效核电荷有关。氮的异常是因为N的p轨道已满,不易再接受电子。R的晶体结构中,两种阳离子可能的相同之处在于它们都是配位化合物,不同之处可能在于配位数或配体种类。N5-中σ键总数为7个,大π键表示为55Π。氢键的表示形式为(NH4+)N−H…Cl、(NH4+)H−N…Cl、(NH4+)H−N…NH4+。晶体密度的计算公式涉及到晶胞参数和晶胞内单元的质量。 4. 铁(Fe)的基态电子排布是[Ar]3d64s2。[Ni(NH3)6]SO4中的SO42-离子构型是正四面体,Ni2+与NH3之间的化学键是配位键,由氨气提供孤对电子。氨的沸点高于膦因为氨存在氢键,而PH3只有范德华力。PH3的P原子杂化轨道类型是sp3。1mol(SCN)2中的π键数目是4。硅酸盐结构中,多硅酸根的化学式可表示为(SiO4)n。碘与锰形成的化合物未给出具体信息,无法确定化学式,晶体密度计算需知道摩尔质量和晶胞体积。 5. 锗(Ge)位于周期表的第四周期,IVA族,其核外电子排布为[Ar]3d104s24p2。锗的化合物在半导体领域具有重要应用,其性质介于导体和绝缘体之间。 这些知识点涵盖了元素周期律、原子结构、化学键、配位化合物、晶体结构、电负性、杂化轨道、电子亲和能、氢键、晶胞参数、电子排布以及半导体材料的基础知识。
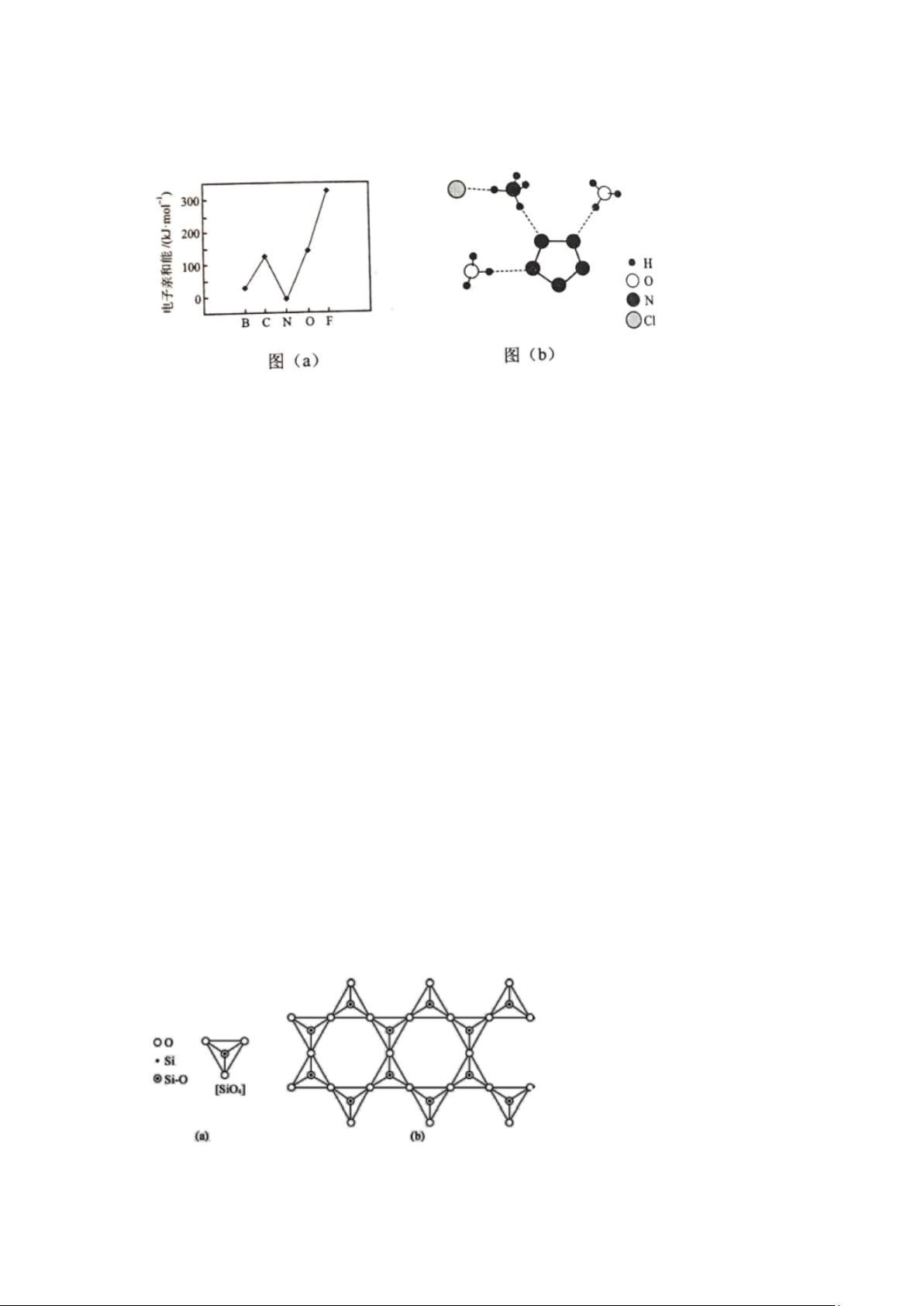
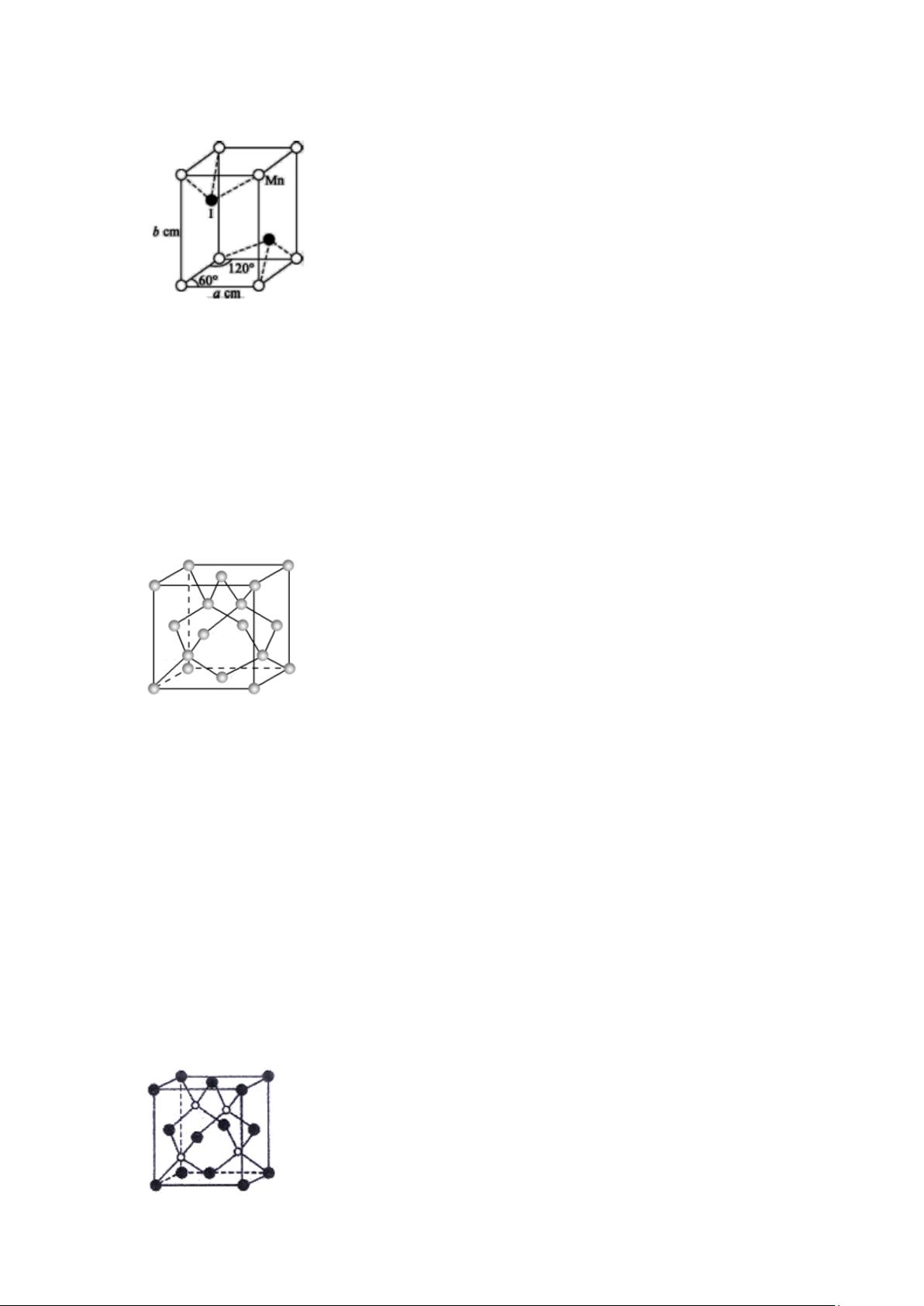
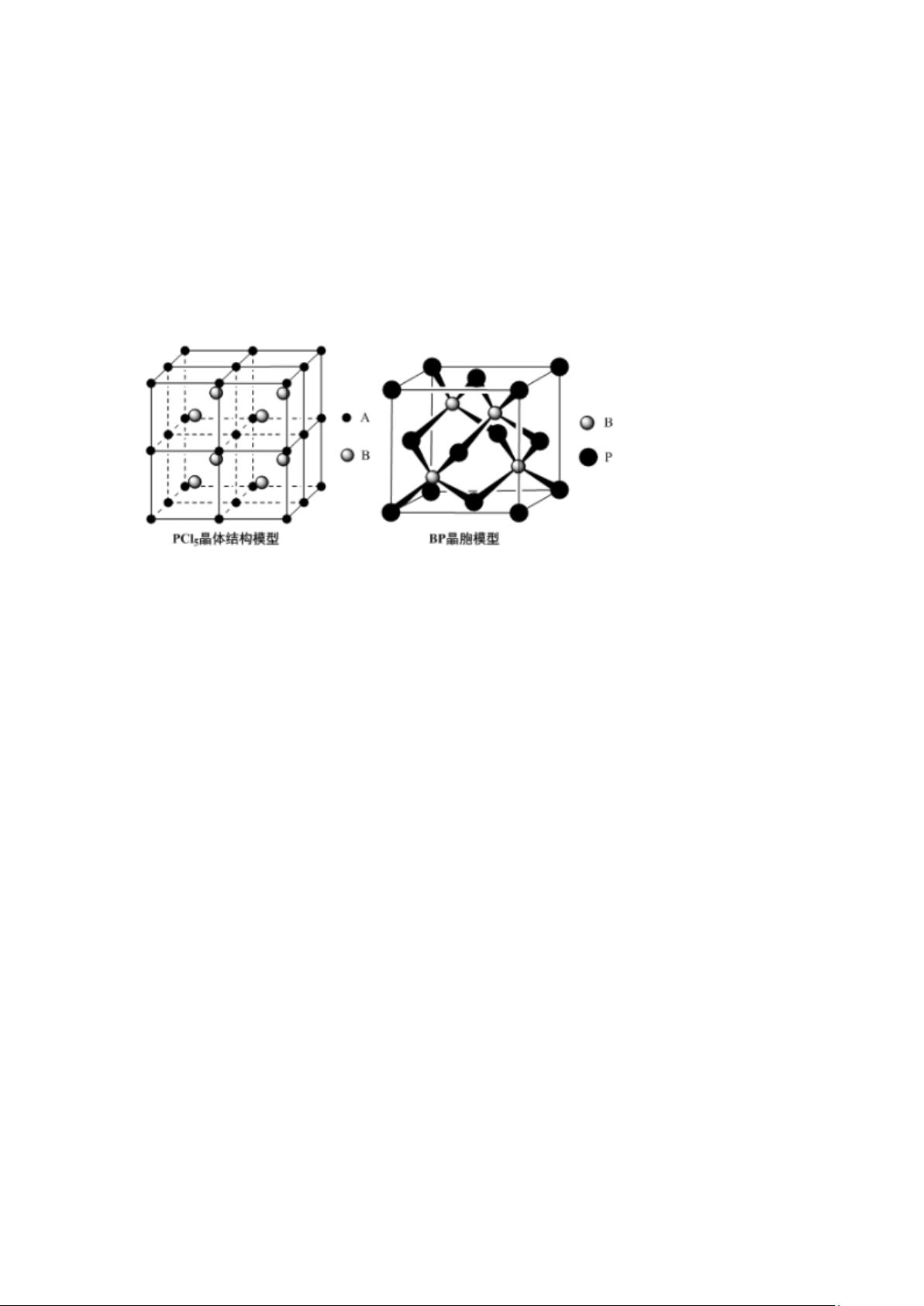
剩余18页未读,继续阅读

- 粉丝: 0
- 资源: 2万+
 我的内容管理
展开
我的内容管理
展开
 我的资源
快来上传第一个资源
我的资源
快来上传第一个资源
 我的收益 登录查看自己的收益
我的收益 登录查看自己的收益 我的积分
登录查看自己的积分
我的积分
登录查看自己的积分
 我的C币
登录后查看C币余额
我的C币
登录后查看C币余额
 我的收藏
我的收藏  我的下载
我的下载  下载帮助
下载帮助

 前往需求广场,查看用户热搜
前往需求广场,查看用户热搜最新资源
- “锂”清过往,合“锂”预期.pdf
- 2025年我国数字经济发展形势展望.pdf
- 2025年我国软件和信息技术服务业发展形势展望.pdf
- 基于python第三方库pybloom-live实现的redis布隆过滤器类
- 2025年我国工业投资发展形势展望.pdf
- 2025年我国工业经济发展形势展望.pdf
- 2025年我国电子信息制造业发展形势展望.pdf
- 商城系统的技术实现:前端到后端的无缝整合
- FW-2024电商消费趋势年度报告.pdf
- 2025年我国网络安全发展形势展望.pdf
- 2025年我国制造业数字化转型发展形势展望.pdf
- 2025年我国新型工业化发展形势展望.pdf
- 2024游戏出海买量数据洞察.pdf
- 1221额的2的2的2额
- HCIA-Datacom仿真环境课程所用软件ENSP
- 深度视频压缩框架:从预测编码到条件编码的技术革新


 信息提交成功
信息提交成功